冻干是市面上一种常见的保存新鲜蔬果的方式,通过先低温后真空的处理方法将蔬果内的水分由冰直接升华成水蒸气,以此来实现脱水保鲜的效果。冻干技术能维持住食物的色香味,并能将食品内大部分的营养的东西保留下来,获得不少消费者的喜爱。

那么人们是否也可以冻干一些肌体组织,保持其内部的有效成分和结构,作为一种活性材料充分的发挥其自身的特性,并用于生物医药领域呢?
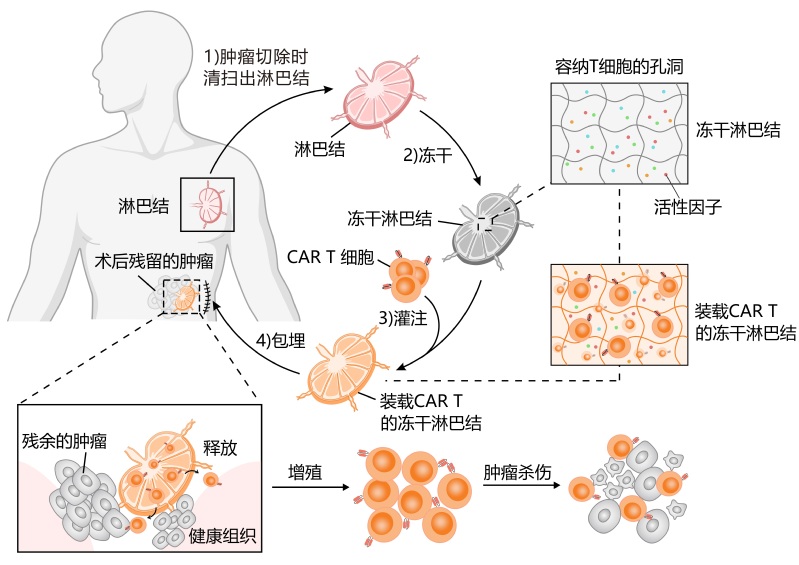
日前,浙江大学药学院、浙江大学金华研究院顾臻教授、李洪军研究员团队联合浙江大学医学院附属第一医院赵鹏主任医师、陈栋主任医师团队,在国际上首次提出利用冷冻干燥技术将肌体组织变为活性生物材料,进而装载药物发挥疗效。在本项研究中,体内取出的淋巴结经冷冻干燥处理后,其多孔结构和大量的活性成分有效保留,将其作为储存和递送抗肿瘤细胞药物的媒介,达到治疗更强效更持久的目的,在动物模型上验证了该技术可有效抑制恶性肿瘤术后的复发。
近年来,细胞药物用作肿瘤靶向治疗方兴未艾。比如,通过给免疫T细胞加装“探头”,合成能够精准识别并定点清除肿瘤细胞的嵌合抗原受体T细胞(又称CAR T细胞),在临床上已被用于血液瘤的治疗,取得显著疗效。
然而CAR T细胞如何在实体肿瘤部位持久且高效地发挥作用,一直是个老大难问题。科学家们尝试在肿瘤附近“搭建”各种可装载CAR T细胞的“碉堡”,用作局部缓控释,但却常常受到诸如物理屏障与免疫抑制环境等因素的阻碍,以及建造“碉堡”的材料所面临的免疫排异反应等,影响疗效。
“我们就在思考,能否用体内的一些肌体组织来装载CAR T细胞呢?”顾臻介绍,“我们第一步想到了肿瘤手术中经常有必要进行清扫的淋巴结,这样就地取材,还能避免由于外源载体带来的排异问题。”
在进行恶性肿瘤切除手术时,往往需要清扫区域内的淋巴结,并通过病理检测判断这些淋巴结是不是已经存在转移,从而在术后精准地指导后续的治疗。而这些切除的淋巴结本身也是人体内很重要的免疫器官,好比是免疫系统中的“兵工厂”,天然就是一个适合T细胞生存、训练、扩增的场所。
“两者的优势是不是能够进一步叠加,既让淋巴结保护CAR T细胞,又能促进细胞的抗肿瘤活性,实现一举两得。”顾臻进一步介绍研究思路。
从2021年起,浙大科研人员就在为如何让“兵工厂”也能成为“碉堡”而努力。
如何让淋巴结留出更多空间装载CAR T细胞?在医用冷冻技术领域有着长期科研实践的顾臻团队,创造性地提出对淋巴结组织进行冷冻干燥的想法。
冻干过程中,淋巴结中水分被冻成冰后迅速升华,产生更多容纳T细胞的空腔。冻干后的淋巴结组织具有很强的吸水性,能迅速吸纳CAR T细胞。
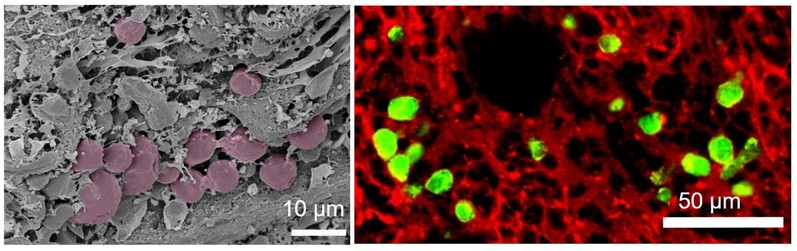
装载CAR-T细胞的冷冻干燥淋巴结扫描电子显微镜图片(左,其中紫色球体为CAR T细胞)与荧光成像图片(右,其中绿色球体为CAR T细胞)
科研人员通过对比实验发现,装载在冻干淋巴结内的CAR T细胞在与肿瘤细胞共培养3天后,其中CAR T细胞扩增量是人工制备的凝胶载体的3.5倍。培养7天后,冻干淋巴结的实验组可以使T细胞分化出更多的记忆表型,这都预示了使用冻干淋巴结载体可以让CAR T疗法更强效、也更持久。
在人源肿瘤细胞系和病人肿瘤组织来源的肿瘤模型研究中,冻干淋巴结对CAR T细胞均具有非常明显的增效能力。“冻干淋巴结装载CAR T细胞治疗后所表现的抑瘤效果、瘤内活化的CAR T细胞数量以及杀伤因子的产生量均显著优于相同剂量CAR T装载于凝胶载体。”李洪军说。
赵鹏表示:“冻干具有‘锁鲜’功能,冻干的淋巴结还将丰富的细胞因子、趋化因子与配体等成分保留了下来,这对CAR T细胞维持活性和功能有着及其重要的作用。”
未来,仅需几个小时,就能够实现淋巴结的冻干与细胞药物的装载,甚至在一场外科手术的时间内,载药的冻干淋巴结就可以填埋回肿瘤切除后的空腔部位,作为一个CAR T细胞储库,源源不断地持续释放药物,以清除局部残留的微小肿瘤,抑制手术后的复发。

“这项研究表现出较强的基础与临床相结合的特征。我们团队多数立意来源于临床实践,平时也会带领学生观摩临床医生查房、手术等。”顾臻说,“团队正在共同细化一些临床研究的方案,使它能够早日帮助到患者。”
不止于此,冻干组织技术不仅仅能用于改造淋巴结、装载CAR T细胞,也为未来科学研究提供了一种新思路。陈栋说:“冷冻干燥技术还可以拓展到其他组织与器官,制备性能特殊的生物材料用于生物医药领域。”
正如匿名审稿人评价的,该工作具有高度的创新性,潜在能够完全满足肿瘤复发治疗方面的重要临床需求。
这项研究第一作者是浙江大学药学院博士生史佳齐、医学院博士生吴伟以及浙江大学医学院附属第一医院陈栋,论文共同通讯作者是顾臻、李洪军以及赵鹏。
(文:李俊元 柯溢能/声像:杨萝萝、刘宇翔、高兴就好 科研图片由受访团队提供)
地址:浙江省杭州市西湖区余杭塘路866号,浙江大学紫金港校区东三105-9